Bei Applus+ Laboratories bieten wir Ihnen unsere hervorragenden Prüfleistungen für Medizinprodukte an. Diese helfen Ihnen dabei, die Entwicklung und die Konformitätsbewertung Ihrer Medizinprodukte und deren Biokompatibilität hinsichtlich regulatorischer Vorgaben zu verbessern und gleichzeitig die Sicherheit Ihrer Produkte zu gewährleisten. Die Biokompatibilitätsprüfung ist Teil unserer anderen Chargenfreigabe-Prüfleistungen:
- Validierung der Reinigung
- Validierung der Verpackung
- Validierung der Stabilität
- Material- und chemische Charakterisierung
Was ist eine Biokompatibilitätsprüfung?
Biokompatibilitätsprüfungen sind Verfahren, mit denen die Verträglichkeit eines Medizinprodukts oder Biomaterials mit biologischen Systemen bewertet wird. Dadurch wird sichergestellt, dass es keine nachteiligen Auswirkungen bei Kontakt mit dem Körper verursacht und bestätigt, dass das Produkt für den Patienten sicher ist.
Die chemische Charakterisierung ist eine der Säulen der biologischen Bewertung eines Medizinprodukts. Ziel dieser Charakterisierung ist es zunächst, die Zusammensetzung eines Medizinprodukts vollständig zu verstehen und sein Potenzial zu bewerten, Substanzen im Körper freizusetzen. Eine kritische Überprüfung dieser Ergebnisse kann die Verpflichtung, eine In-vivo-Bewertung durchzuführen, verringern.
Die chemische Charakterisierung umfasst mehrere Teile der Norm ISO 10993:
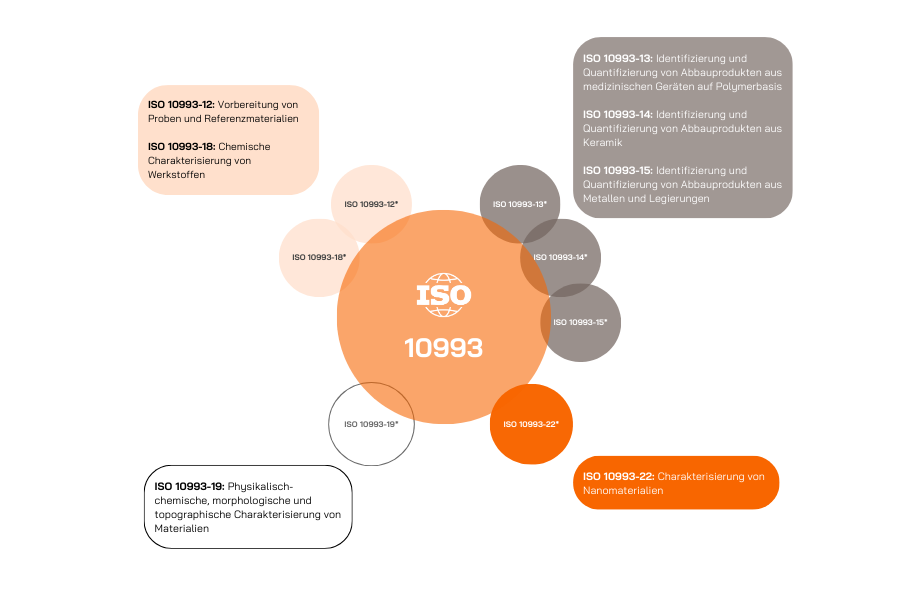
Leitlinien für die Durchführung der Biokompatibilitätsbewertung finden sich in ISO 10993-1; sie geben vor, welche Tests abhängig von der Art des Produkts, der Kontaktdauer und der Art des Körperkontakts erforderlich sind.
Besondere Aufmerksamkeit erfordert das Potenzial des Materials, Verbindungen freizusetzen (im Zusammenhang mit dem Herstellungsprozess oder der Materialdegradation im Anfangsstadium und nach Alterung), um das Ablaufdatum zu validieren.
Welche physikalisch-chemischen Charakterisierungs-Validierungsleistungen bieten wir an?
Die Charakterisierung des Materials in seinem Anfangszustand ist wichtig, um das Risikoniveau und die Freisetzung chemischer Verbindungen oder unkontrollierter Stoffe zu bestimmen, die die allgemeine Sicherheit der Produkte beeinträchtigen könnten. Diese Charakterisierung ist der erste Schritt bei der Entwicklung der Strategie und Anforderungen für die biologische Bewertung.
Die Bestimmung der chemischen Charakterisierung nach Alterung sowie die Wechselwirkung des Medizinprodukts mit seiner Verpackung sind ebenso wichtig, um die Haltbarkeitsdauer und das Verfallsdatum festzulegen.
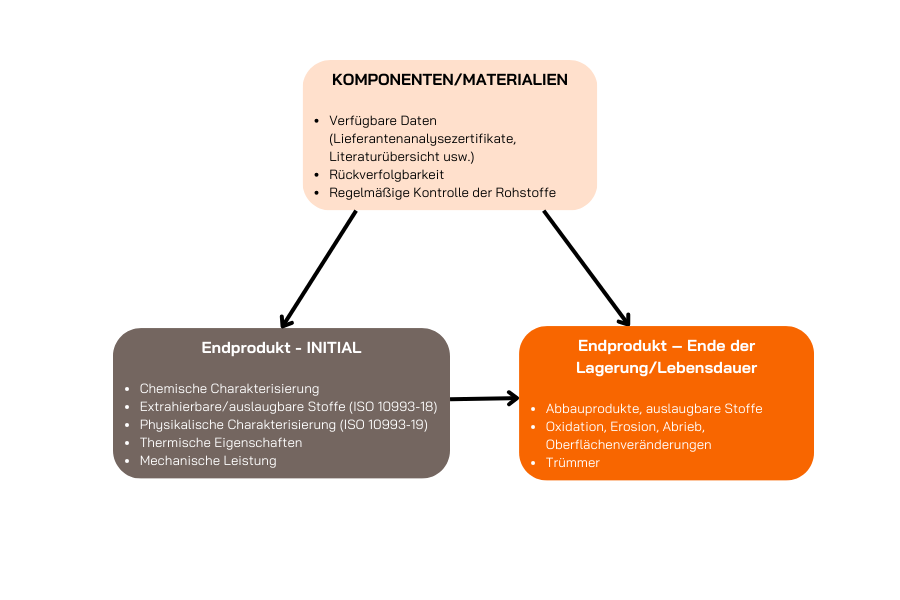
Physikalisch-chemische Analysen gemäß ISO 10993-12 und ISO 10993-18
Diese Erstuntersuchung konzentriert sich auf die Untersuchung der physikalischen und chemischen Eigenschaften der in Medizinprodukten verwendeten Materialien.
Alle Proben von Medizinprodukten werden gemäß den Anforderungen von ISO 10993-12 extrahiert (abhängig von der Kontaktart, Kontaktdauer, dem Zielmarkt und der chemischen Beschaffenheit des Produkts).
Die Norm ISO 10993-18 liefert Hinweise zur Identifizierung und Quantifizierung chemischer Substanzen, die aus dem Medizinproduktmaterial potenziell freigesetzt werden könnten (Extractables und Leachables), sowie zu seiner chemischen Zusammensetzung und Struktur.
- Analyse flüchtiger Verbindungen (VOC) wie Restlösungsmittel (Terpenoide) und Alkohole mittels Headspace-Gaschromatographie (HS-GC-MS)
- Analyse halbflüchtiger Verbindungen (SVOC), z. B. Restmonomere und leicht flüchtige Additive (Alkane, Alkohole, Ester, Siloxane usw.) mittels Gaschromatographie (GC-MS)
- Analyse nichtflüchtiger Verbindungen (NVOC), z. B. Herstellungs- und Materialadditive (Additive mit höherem Molekulargewicht) mittels Flüssigchromatographie (LC-MS)
- Analyse mineralischer und anorganischer Verbindungen mittels ICP-OES und ICP-MS
- Analyse ionischer Verbindungen (Phosphat, Chlorat, Nitrat, Bromid usw.) mittels Ionenchromatographie (IC)
H3: Physikalisch-chemische, morphologische und topografische Charakterisierung von Materialien gemäß ISO 10993-19
Zusätzlich zu diesen obligatorischen Bewertungen kann eine weiterführende chemische Charakterisierung durchgeführt werden, um Ihre Medizinprodukte genauer zu untersuchen (z. B. FTIR, REM, DSC, SEC). Mehr Details dazu finden Sie in der chemischen Charakterisierung.
Als wesentlicher Bestandteil der biologischen Bewertung von Medizinprodukten umfasst dieser Prozess eine umfassende Analyse der physikalischen, chemischen und Oberflächeneigenschaften der verwendeten Materialien, um ihre Sicherheit, Leistung und Biokompatibilität sicherzustellen. Das Verständnis dieser Eigenschaften hilft, vorherzusagen, wie das Material mit biologischen Systemen interagiert.
Die Norm ISO 10993-19 behandelt viele verschiedene Aspekte, von der Analyse der elementaren und molekularen Zusammensetzung eines Materials bis hin zu dessen thermischen Eigenschaften, Oberflächenstruktur und Morphologie sowie Oberflächenbenetzbarkeit und -hydrophobie.
Analyse von Abbauprodukten (ISO 10993-13/14/15)
Ein weiterer entscheidender Faktor ist die Überwachung der Entwicklung des Produkts im Zeitverlauf.
Unkontrollierte Abbauprodukte und Herstellungsrückstände müssen überprüft werden, um die langfristige Sicherheit der Produkte sowohl unter Lagerbedingungen als auch unter realen Einsatzbedingungen zu gewährleisten.
Durch diesen Prozess verstehen wir die Langzeitstabilität und Sicherheit polymerbasierter Medizinprodukte, indem wir etwaige bei der Materialzersetzung über die Zeit freigesetzte Nebenprodukte identifizieren und quantifizieren.
In diesem Teilbereich der Biokompatibilität wird ein Stabilitätstest (siehe Link zur Stabilität) durchgeführt und ähnliche Tests wie in ISO 10993-18 nach der Alterung durchgeführt. Bei metallischen Implantaten können Korrosionsbeständigkeit und Metallfreisetzung bewertet werden.
Welche Biokompatibilitätsleistungen bieten wir an?
Wir bieten unseren Kunden eine Reihe von Biokompatibilitätsleistungen an:
Weitere In-vitro- und In-vivo-Studien
Diese werden außerhalb eines lebenden Organismus (typischerweise in einer kontrollierten Laborumgebung) durchgeführt. Die In-vitro- und In-vivo-Studien sind entscheidend, um die biologische Reaktion auf das Medizinprodukt zu bewerten. Wir können drei verschiedene Tests gemäß verschiedenen Normen durchführen:
- ISO 10993-5 – Zytotoxizität
- ISO 10993-10 – Hautreizung und Sensibilisierung
- ISO 10993-11 – Potenzielle systemische Toxizität von Medizinprodukten
Welche Vorteile bietet die Biokompatibilitätsprüfung?
Die Prüfung der Biokompatibilität von Medizinprodukten ist ein wesentlicher Bestandteil unserer Dienstleistungen, um die Sicherheit und Verträglichkeit dieser Produkte mit biologischen Systemen sicherzustellen und letztendlich die Gesundheit und das Wohlbefinden der Patienten zu schützen, die auf sie angewiesen sind. Zu den Vorteilen dieser Prüfungen gehören unter anderem:
Warum Applus+ Laboratories für Biokompatibilitätsprüfungen wählen?
Wenn Sie sich für Applus+ Laboratories zur Biokompatibilitätsbewertung entscheiden, setzen Sie auf einen führenden Anbieter in der Prüfung von Medizinprodukten. Unsere Leistungen entsprechen den Anforderungen der FDA und den relevanten ISO-Normen und sind speziell darauf ausgerichtet, die strukturelle Integrität und Sicherheit Ihres Medizinprodukts zu gewährleisten.
- Voll ausgestattetes, modernes Labor mit neuester Technologie
- Umfangreiche Fachkompetenz in der Materialbewertung
- Anerkannte und zertifizierte Labore und Mitarbeiter
Dank unseres Standorts in mehreren Ländern bringt Applus+ Laboratories modernste Validierungsprüfungen für Verpackungen zu Kunden weltweit und gewährleistet so den Zugang zu hochwertigen Prüfleistungen – wo auch immer Sie sich befinden.
Wir sind ein globales Unternehmen und bieten unsere Prüfdienstleistungen weltweit an. Dabei stellen wir unseren Kunden stets Biokompatibilitätsprüfungen auf höchstem Niveau zur Verfügung.
Vertrauen Sie auf Applus+ Laboratories als Ihren verlässlichen Partner für Biokompatibilitätsprüfungen. Wir stehen Ihnen mit unseren umfangreichen Leistungen und unserem Expertenwissen jederzeit zur Seite.