Chez Applus+ Laboratories, nous pouvons vous accompagner à travers nos services d’essai sur le développement, la compréhension et la mise en conformité réglementaire de vos dispositifs médicaux. Les essais de biocompatibilité permettent entre autres de vérifier la sécurité de votre dispositifs vis-à-vis du patient.
Ces essais de biocompatibilité s’inscrivent dans le panel d’essai permettant la mise sur marché de votre dispositif:
- Validation du nettoyage
- Validation de l’emballage
- Validation de la stabilité
- Caractérisation des matériaux et analyse chimique
Qu’est-ce que l’essai de biocompatibilité ?
L’essai de biocompatibilité est un processus qui évalue la compatibilité d’un dispositif médical ou d’un biomatériau avec les systèmes biologiques, afin de s’assurer qu’il ne produit pas d’effets indésirables lorsqu’il est en contact avec le corps et qu’il sera donc sûr pour le patient.
L’analyse chimique est l’un des piliers de l’évaluation biologique d’un dispositif médical. L’objectif premier de cette caractérisation est de comprendre pleinement la composition d’un dispositif médical et son potentiel à libérer des substances dans le corps. Un examen critique de ces résultats peut réduire l’obligation de réaliser une évaluation in vivo.
Le référentiel en vigueur pour réaliser l’évaluation biologique et de la biocompatibilité d’un dispositif médical sont retrouvées dans la série de norme ISO 10993 avec la norme ISO 10993-1 fournissant les lignes directrices à suivre selon le type de dispositifs, le temps de contact et la nature du contact avec le corps
Une attention particulière doit être porté au potentiel du matériau à libérer des composés associés aux procédés de fabrication ou à la dégradation du matériau à son stade initial mais également après vieillissement afin de pouvoir établir sa date d’expiration.
L’analyse chimique inclut plusieurs parties de la norme ISO 10993 :
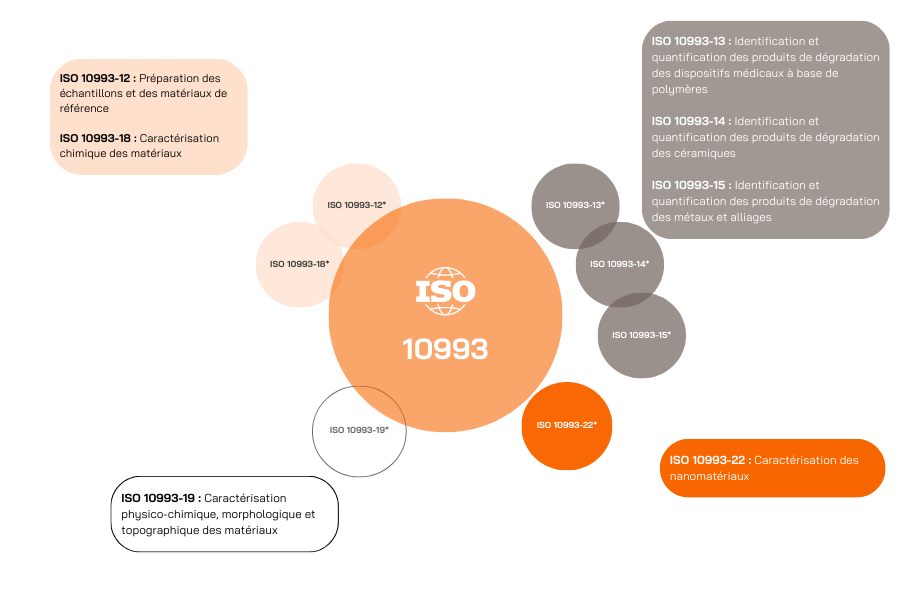
Les lignes directrices pour réaliser l’évaluation de la biocompatibilité se trouvent dans la norme ISO 10993-1 et indiquent les essais à effectuer selon le type de dispositif, la durée du contact et la nature du contact avec le corps.
Une attention particulière doit être portée au potentiel du matériau à libérer des composés (associé au procédé de fabrication ou à la dégradation du matériau à son stade initial et après vieillissement) afin de valider la date de péremption.
Quels services de validation pour la caractérisation physico-chimique proposons-nous ?
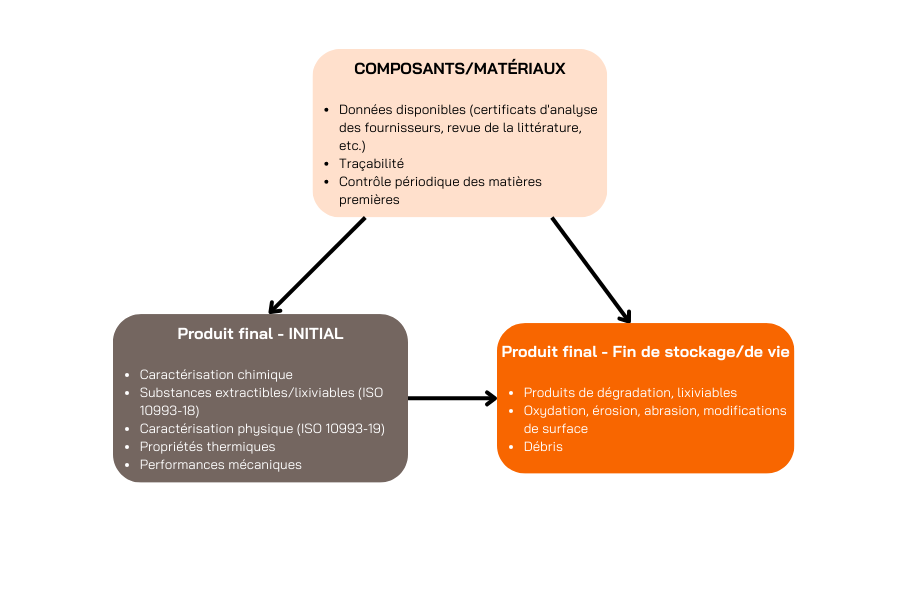
La caractérisation du matériau à son stade initial est essentielle pour déterminer le niveau de risque ainsi que la libération potentielle de composés chimiques ou de produits incontrôlés susceptibles d’affecter la sécurité globale des dispositifs. Cette caractérisation est la première étape dans l’élaboration de la stratégie et des exigences pour l’évaluation biologique.
La caractérisation chimique après vieillissement et l’interaction du dispositif médical avec son emballage sont tout aussi importantes pour déterminer la durée de conservation et fixer la date de péremption.
Analyses physico-chimiques selon ISO 10993-12 et ISO 10993-18
Cette analyse initiale est axée sur l’étude des propriétés physiques et chimiques des matériaux utilisés dans les dispositifs médicaux.
Tous les échantillons de dispositifs médicaux sont extraits conformément aux exigences d’ISO 10993-12 (en fonction de la nature du contact, de la durée, du marché visé et de la nature chimique du dispositif).
La norme ISO 10993-18 fournit des lignes directrices pour identifier et quantifier les substances chimiques susceptibles d’être libérées par le matériau du dispositif médical (extractibles et lixiviables), ainsi que pour analyser sa composition chimique et sa structure.
- Analyse des composés volatils (COV) tels que les solvants résiduels (terpénoïdes) et les alcools par chromatographie en phase gazeuse headspace (HS-GC-MS)
- Analyse des composés semi-volatils (SVOC), par exemple les monomères résiduels et additifs de faible masse molaire (alcanes, alcools, esters, siloxanes, etc.) via chromatographie en phase gazeuse (GC-MS)
- Analyse des composés non volatils (NVOC), tels que les additifs de fabrication et matériaux de poids moléculaire élevé, via chromatographie liquide (LC-MS)
- Analyse des composés minéraux et inorganiques via ICP-OES et ICP-MS
- Analyse des composés ioniques (phosphate, chlorate, nitrate, bromure, etc.) via chromatographie ionique (IC)
Caractérisation physico-chimique, morphologique et topographique des matériaux selon ISO 10993-19
En plus de ces évaluations obligatoires, une caractérisation chimique supplémentaire peut être réalisée pour mieux caractériser vos dispositifs médicaux (FTIR, MEB, DSC, SEC). Vous trouverez plus de détails dans la section dédiée à la caractérisation chimique.
Élément essentiel de l’évaluation biologique des dispositifs médicaux, ce processus implique une analyse approfondie des propriétés physiques, chimiques et de surface des matériaux utilisés afin de garantir leur sûreté, leurs performances et leur biocompatibilité. La compréhension de ces propriétés vous aide à prévoir comment le matériau interagit avec les systèmes biologiques.
La norme ISO 10993-19 couvre de nombreux aspects, de l’analyse de la composition élémentaire et moléculaire du matériau à ses propriétés thermiques, en passant par la structure et la morphologie de sa surface, ainsi que sa mouillabilité ou hydrophobie.
Analyse des produits de dégradation (ISO 10993-13/14/15)
Un autre aspect crucial consiste à contrôler l’évolution du dispositif au fil du temps.
Des produits de dégradation ou résidus de fabrication non contrôlés doivent être vérifiés afin d’assurer la sécurité à long terme des dispositifs, aussi bien dans des conditions de stockage que lors de l’utilisation en conditions réelles.
Grâce à ce processus, nous pouvons comprendre la stabilité et la sûreté à long terme des dispositifs médicaux à base de polymères, en identifiant et quantifiant tout sous-produit libéré à mesure que le matériau se dégrade au fil du temps.
Dans ce volet de la biocompatibilité, des essais de stabilité (voir la section dédiée) sont réalisés, ainsi que des essais similaires à ceux décrits dans ISO 10993-18, mais après vieillissement. Pour les implants métalliques, la résistance à la corrosion et la libération de métal peuvent être évaluées.
Quels services de biocompatibilité proposons-nous ?
Nous proposons un éventail de services de biocompatibilité à nos clients :
Autres études in vitro et in vivo
Réalisées en dehors d’un organisme vivant (généralement dans un environnement de laboratoire contrôlé), les études in vitro et in vivo sont cruciales pour évaluer la réponse biologique au dispositif médical. Nous pouvons effectuer trois types d’essais, selon différentes normes :
- ISO 10993-5 – Cytotoxicité
- ISO 10993-10 – Irritation et sensibilisation cutanée
- ISO 10993-11 – Toxicité systémique potentielle des dispositifs médicaux
Quels sont les avantages de l’essai de biocompatibilité ?
L’essai de biocompatibilité des dispositifs médicaux est un service essentiel que nous offrons afin de garantir la sûreté et la compatibilité de ces dispositifs avec les systèmes biologiques, et in fine de protéger la santé et le bien-être des patients qui en dépendent. Parmi tous les avantages de ces essais, nous soulignons notamment :
- Garantir la sécurité des patients : Les tests de biocompatibilité garantissent que les dispositifs médicaux ne présentent pas de risques tels que la toxicité, l'irritation ou les réactions allergiques lorsqu'ils sont en contact avec le corps humain. Cet aspect est essentiel pour protéger la santé des patients et minimiser les effets indésirables liés à l'utilisation des dispositifs.
- Conformité réglementaire et accès au marché : La conformité aux normes de biocompatibilité (par exemple, la norme ISO 10993) est une exigence réglementaire pour l'approbation des dispositifs médicaux et leur mise sur le marché. Les essais fournissent des données essentielles pour démontrer la sécurité biologique des dispositifs aux autorités réglementaires.
- Atténuation et gestion des risques : Les essais permettent d'identifier et d'atténuer les risques potentiels associés aux matériaux et aux composants des dispositifs médicaux dès le début du processus de développement. Cette approche proactive réduit la probabilité d'événements indésirables et de rappels de produits, améliorant ainsi les stratégies globales de gestion des risques.
- Qualité et fiabilité : Les tests de biocompatibilité sur le produit final, valident la qualité et la fiabilité des matériaux utilisés dans les dispositifs médicaux. En confirmant que ces matériaux répondent aux normes spécifiées en matière de sécurité biologique, les fabricants peuvent garantir une performance et une durabilité constantes des dispositifs au fil du temps.
Pourquoi choisir Applus+ Laboratories pour vos essais de biocompatibilité ?
Choisir Applus+ Laboratories pour votre évaluation de la biocompatibilité, c’est s’associer à un leader reconnu dans le domaine de l’essai de dispositifs médicaux. Nos services, conformes aux exigences de la FDA et aux normes ISO, sont spécifiquement conçus pour garantir l’intégrité structurelle et la sécurité de votre dispositif médical.
- Laboratoire récent et parfaitement équipé avec les dernières technologies
- Compétences solides et expertise approfondie en évaluation des matériaux
- Laboratoires et collaborateurs reconnus et certifiés
Présent dans plusieurs pays, Applus+ Laboratories met ses services avancés d’essais de validation d’emballage à la disposition des clients du monde entier, afin que vous puissiez accéder à des solutions d’essais de premier plan, où que vous soyez.
Nous sommes une entreprise internationale et nous livrons nos services d’essai partout dans le monde, en fournissant des essais de biocompatibilité de premier ordre à tous nos clients.
Faites confiance à Applus+ Laboratories pour être votre partenaire fiable en matière d’essais de biocompatibilité. Nous sommes prêts à soutenir vos projets grâce à notre gamme étendue de services et notre expertise.