En Applus+ Laboratories podemos ofrecerle nuestros excelentes ensayos de dispositivos médicos, que le ayudan a mejorar el desarrollo y la evaluación de conformidad con las Normas regulatorias de sus dispositivos médicos y su biocompatibilidad, al mismo tiempo que se verifica la seguridad de sus productos. El ensayo de biocompatibilidad se incluye con nuestros otros ensayos de liberación de lote:
- Validación de limpieza
- Validación del envasado
- Validación de estabilidad
- Caracterización material y química
¿Qué es el ensayo de biocompatibilidad?
El ensayo de biocompatibilidad es un proceso que evalúa la compatibilidad de un dispositivo médico o un biomaterial con los sistemas biológicos para asegurar que no produzca efectos adversos al entrar en contacto con el cuerpo y confirmar que el dispositivo será seguro para el paciente.
La caracterización química es uno de los pilares de la evaluación biológica de un dispositivo médico. En primer lugar, el objetivo de esta caracterización es comprender completamente la composición y el potencial de un dispositivo médico para liberar cualquier sustancia en el cuerpo. Una revisión crítica de estos resultados obtenidos podría limitar la obligación de realizar una evaluación in vivo.
La caracterización química incluye varias partes de la Norma ISO 10993:
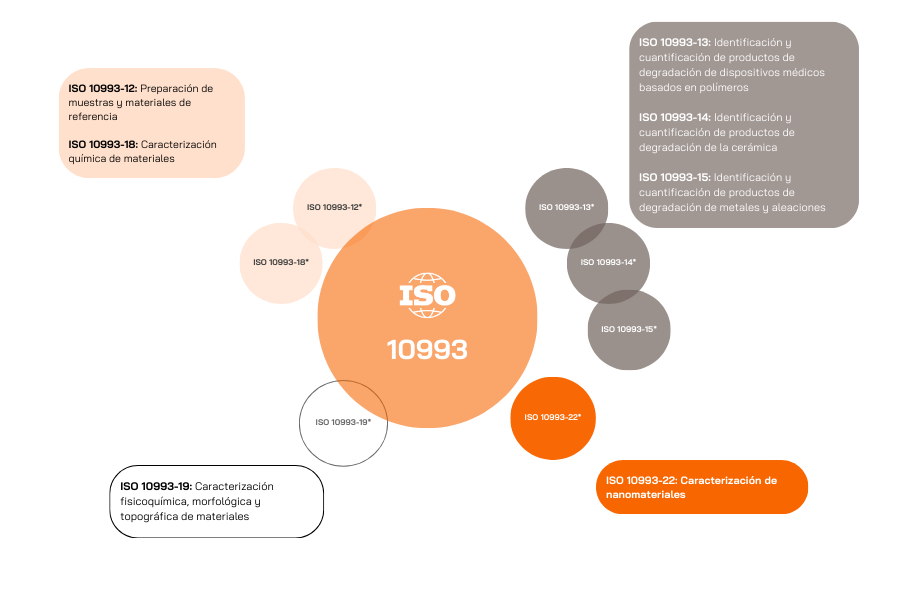
Las directrices para realizar la evaluación de la biocompatibilidad se pueden encontrar en la Norma ISO 10993-1 y proporcionan los ensayos requeridos a realizar según el tipo de dispositivo, la duración del contacto y la naturaleza del contacto con el cuerpo.
Se requiere especial atención al potencial del material para liberar compuestos (asociados al proceso de fabricación, o a la degradación del material en su etapa inicial y tras el envejecimiento para validar la fecha de caducidad.
¿Qué servicios de validación de la caracterización físico-química ofrecemos?
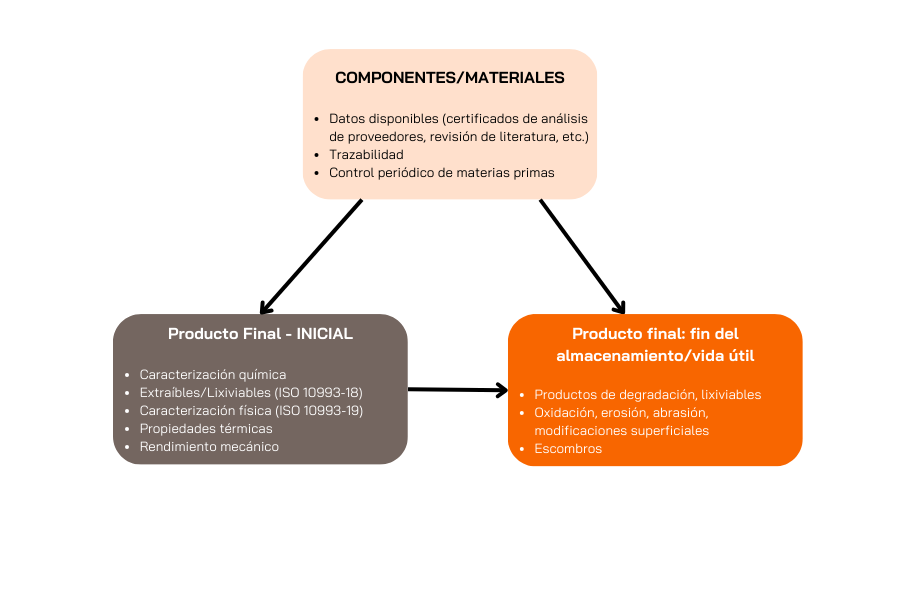
Caracterizar el material en su etapa inicial es importante para determinar el nivel de riesgo y la liberación de compuestos químicos o productos no controlados que podrían impactar la seguridad general de los dispositivos. Esta caracterización es el primer paso en la elaboración de la estrategia y los requerimientos de evaluación biológica.
La determinación de la caracterización química tras el envejecimiento y la interacción del dispositivo médico con su envasado es igualmente importante para establecer la vida útil y determinar la fecha de caducidad.
Análisis físico-químicos según la Norma ISO 10993-12
Este análisis inicial se centra en estudiar las propiedades físicas y químicas de los materiales utilizados en dispositivos médicos.
Todas las muestras de dispositivos médicos se extraen de acuerdo con los requisitos de la Norma ISO 10993-12 (dependiendo de la naturaleza del contacto, la duración, el mercado objetivo y la naturaleza química del dispositivo).
La Norma ISO 10993-18 proporciona orientación sobre la identificación y cuantificación de sustancias químicas que podrían liberarse potencialmente del material del dispositivo médico, sustancias extraíbles y lixiviables, la composición química del material y su estructura química.
- Análisis de compuestos volátiles (VOC) como solvente residual (terpenoide) y alcoholes mediante cromatografía de cabeza (HS-GC-MS)
- Análisis de compuestos semivolátiles (SVOC) como monómero residual y aditivos de bajo peso (alcanos, alcoholes, ésteres, siloxanos…) mediante cromatografía de gases (GC-MS)
- Análisis de compuestos no volátiles (NVOC) como aditivos de fabricación y de materiales (aditivo de alto peso) mediante cromatografía líquida (LC-MS)
- Análisis de compuestos minerales e inorgánicos mediante ICP-OES e ICP-MS
- Análisis de compuestos iónicos (fosfato, clorato, nitrato, bromuro,…) mediante cromatografía iónica (CI)
Caracterización fisicoquímica, morfológica y topográfica de materiales según la Norma ISO 10993-19
Además de estas evaluaciones obligatorias, se podría realizar una caracterización química adicional para caracterizar mejor sus dispositivos médicos (FTIR, SEM, DSC, SEC). Más detalles en la caracterización química.
Parte esencial de la evaluación biológica de los dispositivos médicos, este proceso implica un análisis integral de las propiedades físicas, químicas y superficiales de los materiales utilizados en dispositivos médicos para garantizar su seguridad, rendimiento y biocompatibilidad. Comprender estas propiedades le ayudará a predecir cómo interactuará el material con los sistemas biológicos.
La Norma ISO 10993-19 abarca muchas dimensiones diferentes, desde el análisis de la composición elemental y molecular de los materiales hasta sus propiedades térmicas, la estructura y morfología de la superficie o la humectabilidad y la hidrofobicidad de la misma.
Análisis de productos de degradación (ISO 10993-13/14/15)
Otro aspecto crucial es controlar la evolución del dispositivo a lo largo del tiempo.
Los subproductos de degradación y los productos resultantes de la fabricación no controlados son, en última instancia, algo que se debe verificar para asegurar la seguridad a largo plazo de los dispositivos, tanto en condiciones de almacenamiento como en condiciones de uso.
A través de este proceso, podemos entender la estabilidad y seguridad a largo plazo de los dispositivos médicos basados en polímeros, identificando y cuantificando cualquier subproducto liberado a medida que el material se descompone con el tiempo.
En esta parte de la biocompatibilidad, se realiza el ensayo de estabilidad y se efectúan ensayos similares a los de la Norma ISO 10993-18 después del envejecimiento. Se podría evaluar la resistencia a la corrosión y la lixiviación metálica en implantes metálicos.
¿Qué servicios de biocompatibilidad ofrecemos?
Ofrecemos una gama de servicios de biocompatibilidad para nuestros clientes:
Otros estudios in vitro e in vivo
Realizados fuera de un organismo vivo (típicamente en un entorno de laboratorio controlado), los estudios in vitro e in vivo son cruciales para evaluar la respuesta biológica al dispositivo médico. Existen 3 ensayos diferentes que podemos realizar, de acuerdo con distintas normas:
- ISO 10993-5 - Citotoxicidad
- ISO 10993-10 - Irritación y sensibilización cutánea
- ISO 10993-11 - Toxicidad sistémica potencial de dispositivos médicos
¿Cuáles son los beneficios del ensayo de biocompatibilidad?
Ensayar la biocompatibilidad de los dispositivos médicos es un servicio esencial que realizamos para garantizar la seguridad y la compatibilidad de estos dispositivos con los sistemas biológicos y, en última instancia, proteger la salud y el bienestar de los pacientes que dependen de ellos para el tratamiento y cuidado médico. Entre todos los beneficios que incluye este ensayo, nos gustaría destacar:
¿Por qué elegir Applus+ Laboratories para el ensayo de biocompatibilidad?
Elegir Applus+ Laboratories para su evaluación de biocompatibilidad lo alinea con un líder distinguido en el ensayo de dispositivos médicos. Nuestros servicios, conformes con los requisitos de la FDA y las Normas ISO, están diseñados específicamente para garantizar la integridad estructural y la seguridad de su dispositivo médico.
- Laboratorio totalmente equipado y moderno con las últimas tecnologías
- Amplia experiencia y habilidades en la evaluación de materiales
- Laboratorios y empleados reconocidos y certificados
Con operaciones en varios países, Applus+ Laboratories lleva nuestros servicios de validación de envasado de vanguardia a clientes en todo el mundo, garantizando el acceso a soluciones de ensayo superiores dondequiera que se encuentren.
Somos una empresa global y, por lo tanto, ofrecemos nuestros servicios de ensayo en cualquier parte del mundo, proporcionando ensayos de biocompatibilidad de primer nivel a todos nuestros clientes.
Confíe en Applus+ Laboratories como su socio de confianza para el ensayo de biocompatibilidad. Estamos listos para apoyar sus esfuerzos con nuestros amplios servicios y conocimientos expertos.